Materi Kimia Larutan Asam Basa Kelas 11 Beserta Contoh dan Penjelasan
Larutan Asam Basa Kelas 11 – Salah satu istilah kimia yang mungkin tidak asing lagi bagi sahabat pencinta ilmu Kimia yaitu Asam dan Basa. Untuk materi kimia larutan asam basa kali ini khusus kelas 11 akan dikaitkan dalam kehidupan sehari-hari yang bisa kita jumpai dan banyak dimanfaatkan oleh masyarakat secara umum.
 |
| Larutan Asam Basa Kelas 11 |
Materi Kimia Larutan Asam Basa Kelas 11
Senyawa asam dapat dengan mudah ditemukan pada buah-buahan, seperti jeruk dan lemon. Selain itu, bisa juga ditemukan pada bahan makanan, seperti cuka. Bahkan, senyawa asam juga banyak digunakan sebagai bahan pengawet makanan, misalnya asam benzoat yang dimanfaatkan sebagai pengawet jus buah dan selai. Sedangkan untuk senyawa basa, umumnya dapat ditemukan pada benda yang rasanya pahit, seperti obat atau sabun.
Berarti, kalau mau membedakan asam dan basa, kita harus tahu rasanya masam atau pahit, ya? Yap, nggak gitu sobat!
Ada cara yang lebih aman untuk membedakan mana yang merupakan senyawa asam dan mana yang merupakan senyawa basa. Salah satunya seperti yang sudah disebutkan di atas tadi, yaitu menggunakan indikator lakmus atau pH meter.
Selain itu, sahabat juga bisa menggunakan bahan-bahan alami yang berwarna cerah sebagai indikator untuk mengidentifikasi asam dan basa. Misalnya, bunga sepatu dan bunga kana. Ketika bunga sepatu dan bunga kana ini dimasukan kedalam larutan asam, maka warnanya akan berubah menjadi lebih muda dan terang daripada warna semula. Tapi, jika dimasukan ke dalam larutan basa, maka warnanya akan berubah menjadi lebih gelap dari warna semula.
Sifat Asam Basa
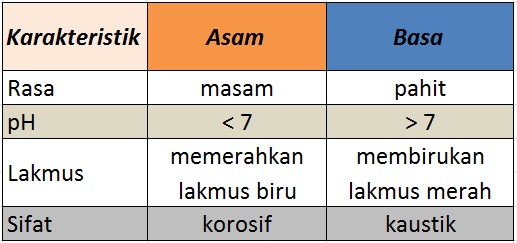
Asam dan basa memiliki sifat yang berbeda. Sifat atau karakteristik asam dan basa dapat sahabat lihat pada tabel di bawah:
 |
| Sifat Asam dan Basa |
Seperti yang tadi sudah dibahas, dari segi rasa, asam memiliki rasa yang masam sedangkan basa memiliki rasa yang pahit. Lalu, dari segi pH, asam memiliki pH di bawah 7, sedangkan basa memiliki pH di atas 7. Jika suatu larutan memiliki pH 7 artinya larutan tersebut sifatnya netral, tidak bersifat asam maupun basa.
Kemudian, ciri selanjutnya dapat dilihat dari indikator asam basa yang biasa digunakan yaitu lakmus. Jika suatu larutan bersifat asam, maka ia akan memerahkan lakmus biru. Sementara itu, jika larutannya bersifat basa maka ia akan membirukan lakmus merah. Jangan terbalik, ya! Terakhir, larutan atau senyawa asam bersifat korosif, sedangkan basa bersifat kaustik.
Cara Membuat Larutan Asam Basa
Larutan asam dan basa dapat diperoleh dengan melarutkan asam atau basa secara langsung ke dalam air. Selain itu, larutan ini juga dapat diperoleh melalui reaksi antara senyawa oksida dengan air.
- Membuat Larutan Asam
Reaksi antara oksida asam dengan air akan menghasilkan larutan asam, sedangkan reaksi antara oksida basa dengan air akan menghasilkan larutan basa. Larutan basa juga dapat dihasilkan dari reaksi antara logam reaktif dengan air.
Oksida sendiri merupakan senyawa yang terbentuk antara unsur tertentu dengan oksigen. Oksida asam adalah oksida yang berasal dari unsur nonlogam dengan oksigen, misalnya CO2, SO2, P2O5, Cl2O7 dan sebagainya. Oksida asam akan menghasilkan larutan asam jika bereaksi dengan air. Contoh reaksi yang menghasilkan larutan asam bisa sahabat lihat pada gambar berikut:
 |
| Rumus Kimia Reaksi Larutan Asam |
- Membuat Larutan Basa
Larutan basa dapat dibentuk dengan mereaksikan oksida basa dengan air. Oksida basa adalah oksida yang berasal dari unsur logam dengan oksigen, misalnya Na2O, CaO, Fe2O3, dan sebagainya. Contoh reaksi yang menghasilkan larutan basa bisa sahabat lihat pada gambar berikut:
 |
| Rumus Kimia Reaksi Larutan Basa |
Tapi, perlu diperhatikan, bahwa di antara senyawa oksida, ada yang disebut oksida indiferen, yaitu oksida yang tidak dapat membentuk asam maupun basa, misalnya CO dan NO.
Selain itu, ada juga oksida amfoter. Amfoter artinya dapat bereaksi dengan ion asam (H+) dan ion basa (OH-). Contoh oksida amfoter adalah Al2O3 dan ZnO.
Klasifikasi Asam dan Basa
Asam dan basa dibagi menjadi dua macam, yaitu asam kuat dan basa kuat, serta asam lemah dan basa lemah. Kuat dan lemahnya tuh maksudnya apa? Nach mari kita bahas satu per satu!
1. Asam Kuat dan Basa Kuat
Asam kuat adalah senyawa asam yang mudah melepaskan ion H+ dalam air dan mengalami disosiasi total dalam larutannya. Contoh asam kuat yaitu HCl, HNO3, H2SO4, dan HCIO4.
Sedangkan basa kuat adalah senyawa basa yang mudah melepaskan ion OH- dalam air dan mengalami disosiasi total dalam larutannya. Contoh basa kuat yaitu NaOH, KOH, dan Ba(OH)2.
2. Asam Lemah dan Basa Lemah
Asam lemah adalah senyawa asam yang sulit melepaskan ion H+ dalam air dan mengalami disosiasi sebagian dalam larutannya. Contoh asam lemah yaitu H3PO4, H2SO3, HNO2, dan CH3COOH.
Basa lemah adalah senyawa basa yang sulit melepaskan ion OH- dalam air dan mengalami disosiasi sebagian dalam larutannya. Contoh basa lemah yaitu NaHCO3 dan NH4OH.
Demikian penjelasan mengenai Materi Kimia Kelas 11 Kurikulum 2013 (K13) tentang larutan Asam Basa, semoga bermanfaat dan berberkah.