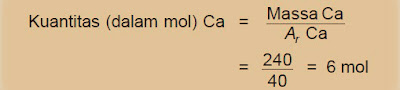Hubungan Mol dengan Jumlah Partikel, Massa Zat, Volume Zat, Rumus dan Contoh Penyelesaian Mol
Hubungan Mol dengan Jumlah Partikel, Massa Zat, Volume Zat, Rumus dan Contoh Penyelesaian Mol - Sahabat tentu pernah mendengar satuan dosin, gros, rim, atau kodi untuk menyatakan jumlah benda. Banyaknya partikel dinyatakan dalam satuan mol. Satuan mol sekarang dinyatakan sebagai jumlah partikel (atom, molekul, atau ion) dalam suatu zat. Para ahli sepakat bahwa satu mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12,0 gram isotop C-12 yakni 6,02 x 1023 partikel. Jumlah partikel ini disebut Bilangan Avogadro (NA = Number Avogadro) atau dalam bahasa Jerman Bilangan Loschmidt (L). Jadi, definisi satu mol adalah sebagai berikut:
Satu mol zat menyatakan banyaknya zat yang mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12,0 gram isotop C-12.
Nilai NA sebesar 6,02 x 1023
 |
| Hubungan Mol dengan Jumlah Partikel, Massa Zat, Volume Zat, Rumus dan Contoh Penyelesaian Mol |
1. 1 mol unsur Na mengandung 6,02 x 1023 atom Na.
2. 1 mol senyawa air mengandung 6,02 x 1023 molekul air.
3. 1 mol senyawa ion NaCl mengandung 6,02 x 1023 ion Na+dan 6,02 x 1023 ion Cl–.
Konsep Mol
1. Hubungan mol dengan jumlah partikel
Hubungan mol dengan jumlah partikel dapat dirumuskan:
Contoh soal:
Suatu sampel mengandung 1,505 x 1023 molekul Cl2, berapa mol kandungan Cl2 tersebut?
Jawab:
2. Hubungan mol dengan massa
Sebelum membahas hubungan mol dengan massa terlebih dahulu akan diperkenalkan Massa Atom Relatif dan Massa Molekul Relatif.
a. Massa Atom Relatif (Ar)
IUPAC telah menetapkan 1 sma = 1/12 massa satu atom C-12 isotop Atom H mempunyai kerapatan 8,400% dari kerapatan C-12. Jadi, massa atom H = 0,08400 x 12,00 sma = 1,008 sma. Dari perhitungan yang sama kita bisa mengetahui massa atom O = 16,00 sma. Demikian juga massa atom unsur-unsur yang lain. Massa Atom Relatif (Ar) adalah perbandingan massa rata-rata suatu atom unsur terhadap 1/12 massa satu atom isotop C-12.
Di alam umumnya unsur terdiri atas campuran isotop, sehingga massa atomnya diambil rata-rata dari campuran isotopnya.
Contoh: Di alam terdapat campuran 35Cl dan 37Cl dengan perbandingan 75% dan 25%. Ar Cl = (75% x 35) + (25% x 37) = 35,5
b. Massa Molekul Relatif (Mr)
Massa molekul relatif (Mr) adalah perbandingan massa rata-rata satu molekul suatu senyawa terhadap 1/12 massa 1 atom isotop C-12.
Berdasarkan pengertian molekul yang menyatakan bahwa molekul merupakan gabungan dari atomatomnya, maka Mr merupakan jumlah Ar atom-atom penyusunnya.
Mr = Σ Ar
Contoh soal:
Hitung Mr H2SO4 (Ar H = 1, S = 32, dan O = 16)!
Jawab:
Mr H2SO4 = (2 x Ar H) + (1 x Ar S + 4 x Ar O)
= (2 x 1) + (1 x 32) + (4 x 16)
= 2 + 32 + 64
= 98
c. Massa Molar
Massa molar menyatakan massa yang dimiliki oleh 1 mol zat, yang besarnya sama dengan Ar atau Mr.
Untuk unsur:
1 mol unsur = Ar gram, maka dapat dirumuskan:
Massa 1 mol zat = Ar zat dinyatakan dalam gram
Untuk senyawa:
1 mol senyawa = Mr gram, maka dapat dirumuskan:
Massa 1 mol zat = Mr zat dinyatakan dalam gram
Contoh soal:
1) Hitung kuantitas dalam mol dari 240 gram Ca, jika diketahui Ar Ca = 40!
Jawab:
2) Berapa gram besarnya massa dari 3 mol gas CO2? (Ar C = 12, O = 16)
Jawab:
Mr CO2 = (1 x Ar C) + (2 x Ar O)
= (1 x 12) + (2 x 16)
= 12 + 32
= 44
Massa CO2 = mol x Mr
= 3 x 44
= 132 gram
3. Hubungan mol dengan volume
a. Gas pada keadaan standar
Pengukuran kuantitas gas tergantung suhu dan tekanan gas. Jika gas diukur pada keadaan standar, maka volumenya disebut volume molar. Volume molar adalah volume 1 mol gas yang diukur pada keadaan standar. Keadaan standar yaitu keadaan pada suhu 0 °C (atau 273 K) dan tekanan 1 atmosfer (atau 76 cmHg atau 760 mmHg) atau disingkat STP (Standard Temperature and Pressure).
Besarnya volume molar gas dapat ditentukan dengan persamaan gas ideal:
PV = nRT
P = tekanan = 1 atm
n = mol = 1 mol gas
T = suhu dalam Kelvin = 273 K
R = tetapan gas = 0,082 liter atm/mol K
Maka:
P V = nRT
1 x V = 1 x 0,082 x 273
V = 22,389
V = 22,4 liter
Jadi, volume standar = VSTP = 22,4 liter.
Dapat dirumuskan:
V = n x Vm
n = jumlah mol
Vm = VSTP = volume molar
Contoh soal:
1) Berapa kuantitas (dalam mol) gas hidrogen yang volumenya 6,72 liter, jika diukur pada suhu 0 °C dan tekanan 1 atm?
Jawab:
2) Hitung massa dari 4,48 liter gas C2H2 yang diukur pada keadaan standar!
Jawab:
Massa C2H2 = mol x Mr C2H2
= 0,2 x 26
= 5,2 gram
3) Hitung volume dari 3,01 x 1023 molekul NO2 yang diukur pada suhu 0 °C dan tekanan 76 cmHg!
Jawab:
b. Gas pada keadaan nonstandar
Jika volume gas diukur pada keadaan ATP (Ambient Temperature and Pressure) atau lebih dikenal keadaan non–STP maka menggunakan rumus:
PV = nRT
P = tekanan, satuan P adalah atmosfer (atm)
V = volume, satuan V adalah liter
n = mol, satuan n adalah mol
R = tetapan gas = 0,082 liter atm mol–1 K–1
T = suhu, satuan T adalah Kelvin (K)
Contoh soal:
Tentukan volume 1,7 gram gas amonia yang diukur pada suhu 27 °C dan tekanan 76 cmHg!
Jawab:
Demikian ulasan mengenai hubungan mol dengan jumlah partikel, massa zat, volume zat, rumus dan contoh penyelesaian mol yang dapat kami bagikan pada kesempatan kali ini. Semoga bermanfaat.
Pustaka:
[Mol dalam RumusKimia.net; Kimia SMA/MA; Image from Google Images]
Pustaka:
[Mol dalam RumusKimia.net; Kimia SMA/MA; Image from Google Images]