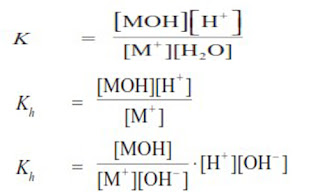Hidrolisis Garam dari Asam Kuat dan Basa Lemah
Hidrolisis Garam dari Asam Kuat dan Basa Lemah – Materi kimia berikut akan dijelaskan tentang Hidrolisis Garam dari Asam Kuat dan Basa Lemah. Garam dari asam kuat dan basa lemah jika dilarutkan dalam air juga akan mengalami hidrolisis sebagian. Hal ini disebabkan karena kation dari basa lemah dapat terhidrolisis, sedangkan anion dari asam kuat tidak mengalami hidtrolisis.
Hidrolisis Garam dari Asam Kuat dan Basa Lemah
Misalnya:
NH4Cl → NH4+ + Cl-
NH4+ + H2O ⇄ NH4OH + H+
Cl- + H2O → tidak terjadi reaksi
pH larutan garam ini dapat ditentukan melalui persamaan:
M+ + H2O ⇄ MOH + H+
Tetapan Hidrolisis Garam dari Asam Kuat dan Basa Lemah:
Sehingga:
dengan:
- Kw= tetapan kesetimbangan air
- Kb = tetapan ionisasi basa lemah
pH larutan garam:
Sehingga:
Contoh:
Hitunglah pH larutan NH4Cl 0,01 M (Kb NH4OH = 2 x 10-5)!
Jawab:
pKb = – log Kb
= – log 2 × 10-5
= 5 – log 2
= 4,7
pH =1/2 (14 – pKb – log 10-2 )
= 1/2 (14 – 4,7 + 2)
= 5,65
Demikian penjelasan mengenai Hidrolisis Garam dari Asam Kuat dan Basa Lemah, semoga dapat bermanfaat bagi kita semua.
Lihat juga: